Las proteínas son uno de los componentes principales de la dieta y, al ser digeridas en el tracto gastrointestinal, se hidrolizan en aminoácidos libres y una gran cantidad de péptidos, algunos de los cuales son absorbidos y transportados por el torrente circulatorio. Se ha descrito que algunos de esos péptidos derivados de los alimentos comparten estructuras moleculares con los péptidos endógenos, lo cual podría permitir a los péptidos alimentarios interactuar con los receptores del organismo, tal y como ocurre con los péptidos opiáceos, o inhibir ciertos enzimas reguladores.
A estos péptidos, generalmente de pequeño tamaño (entre 2 y 15 residuos de aminoácidos) se les conoce como péptidos bioactivos y son foco de gran interés científico debido a su variedad y multifuncionalidad. Entre ellos, los péptidos antihipertensivos son indudablemente el grupo del cual se encuentra más información disponible y cuya caracterización y demostración de su efecto en estudios clínicos ha llegado más lejos.
En el contexto de las proteínas alimentarias, las lácteas han demostrado ser fuente de numerosos péptidos antihipertensivos. Diversos estudios sugieren que el consumo de leche y productos lácteos está inversamente relacionado con el riesgo de padecer hipertensión. La leche es rica en minerales (como el calcio y el potasio, entre otros) que son capaces de reducir la presión sanguínea. Pero además en su composición existen otros elementos, como las proteínas y sus péptidos derivados, los cuales también han sido relacionadas con el efecto antihipertensivo. Estos péptidos podrían interaccionar con los principales componentes de los sistemas de regulación de la presión arterial, como el RAS, el sistema quinina-calicreína, y los sistemas NEP y ET. Sin embargo, en la actualidad ECA es la diana principal de los péptidos antihipertensivos derivados de proteínas lácteas.
La caracterización de los péptidos antihipertensivos incluye como estrategia más común ensayos de inhibición in vitro de la ECA y experimentos in vivo con animales. Los primeros miden la conversión enzimática de un sustrato apropiado en presencia y ausencia de péptido, y la potencia inhibitoria se expresa con el valor de IC50, que se define como la concentración de péptido necesaria para inhibir la actividad ECA en un 50%. Para ello se han descrito métodos basados en la detección espectrofotométrica o fluorimétrica, y también ensayos cromatográficos.
Para los experimentos in vivo se utilizan ratas espontáneamente hipertensas (SHR) que constituyen un modelo animal científicamente aceptado para estudiar la hipertensión (FitzGerald y cols., 2004). Estos estudios incluyen administración aguda y crónica de los péptidos antihipertensivos, y en algunos casos se evalúa también el efecto de los péptidos en la presión arterial de ratas normotensas. Además, los ensayos funcionales ex vivo, empleando arterias aisladas, permiten conocer los efectos vasoactivos de los péptidos (Centeno y cols., 2006). Finalmente, los estudios clínicos deben demostrar la eficacia de los péptidos antihipertensivos estableciéndose las dosis adecuadas.
Los péptidos antihipertensivos derivados de proteínas lácteas son producidos principalmente mediante fermentación con bacterias ácido lácticas (BAL) o mediante hidrólisis enzimática. Ambas estrategias han permitido aislar secuencias con efectos antihipertensivos tanto en animales de experimentación como en ensayos clínicos. La primera aproximación se basa en la capacidad del sistema proteolítico de las BAL para hidrolizar las proteínas, principalmente las caseínas, durante la producción de productos lácteos como leches fermentadas o quesos. De esta manera se originan péptidos y aminoácidos que serán utilizados como fuente de nitrógeno para el crecimiento bacteriano.
Diferentes especies bacterianas pertenecientes a los géneros Lactobacillus, Lactococcus, Streptococcus y Enterococcus, entre otros, son capaces de liberar péptidos antihipertensivos. Por lo que se refiere a la hidrólisis enzimática, se emplean enzimas implicadas en la digestión gastrointestinal como la pepsina gástrica o la tripsina pancreática, y también enzimas de origen vegetal y microbiano. Esta estrategia se ha aplicado tanto a caseínas como a las proteínas del suero.
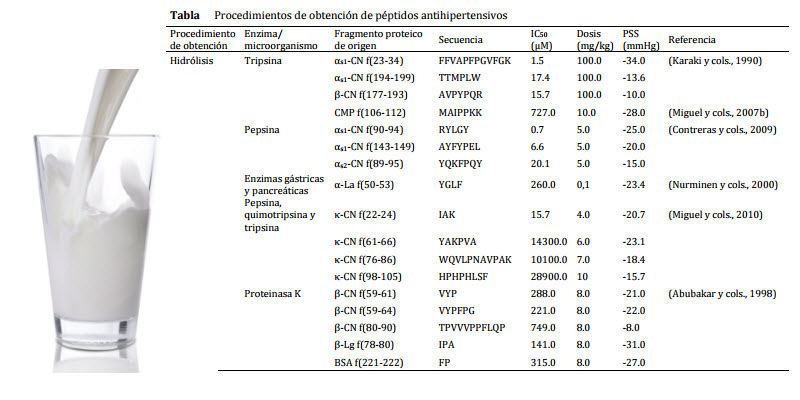
Algunos ejemplos de péptidos antihipertensivos derivados de proteínas lácteas aislados a partir de hidrolizados enzimáticos se presentan en la Tabla. En general, hay una falta de correlación entre la potencia inhibitoria in vitro de ECA y el efecto antihipertensivo in vivo. Este hecho se ha relacionado fundamentalmente con la biodisponibilidad de los péptidos, que tras su administración oral suele ser bastante limitada. Por el contrario, también debe tenerse en cuenta que la degradación de los péptidos puede originar secuencias peptídicas con mayor potencia inhibitoria de la ECA y mayor efecto antihipertensivo.
Asimismo, cada vez hay más evidencias que apuntan a la posibilidad de que el efecto in vivo de los péptidos antihipertensivos no sólo se limite a la inhibición de la ECA (enzima conversora de angiotensina).